Molekulare Hyperthermie
Die supraphysiologische Erwärmung (lat.: Hyperthermie) ist eine der ältesten Methoden zur Behandlung entarteter Zellen und wurde erstmals um 5000 v.Chr. erwähnt. Bedeutende technische Fortschritte im Bereich der Radiofrequenz-Applikatoren (13.45 MHz bis 2.45 GHz) und der nicht-invasiven MR-Thermometrie führten ab den 1970er Jahren dazu, dass die Hyperthermie auch bei der gezielten Behandlung von Tumoren eingesetzt werden kann. Im Rahmen einer Hyperthermiebehandlung wird der Tumor ein oder zweimal pro Woche auf eine Zieltemperatur zwischen 39 °C und 45 °C für ca. 60 Minuten erwärmt. Wenn die klinische Hyperthermie verantwortlich verschrieben, sorgfältig durchgeführt und in ihren Wirkungen und Nebenwirkungen lückenlos dokumentiert wird, kann sie auf verschiedenen Ebenen zu signifikanten Verbesserungen führen. Letzteres gelingt allerdings nur, wenn die Hyperthermie in Form einer multimodalen Behandlung, d.h. in Kombination mit einer Radio(chemo)therapie und gegebenenfalls Immuntherapie, eingesetzt wird.
Die Molekulare Hyperthermie befasst sich mit der Aufklärung grundlegender immunbiologischer und physikalischer Mechanismen, die während der Hyperthermie und im Rahmen von Kombinationsbehandlungen stattfinden. Um grundlegende Erwärmungseffekte außerhalb des Organismus (ex vivo) zu untersuchen, verfügt die Arbeitsgruppe über Erwärmungskammern und z.T. selbst entwickelte radiative (Mikrowellen)Systeme, die der klinischen Hyperthermie stark ähneln. Um immunbiologische Erwärmungseffekte auch innerhalb des Körpers (in vivo) zu erforschen, werden in der Arbeitsgruppe unter Einhaltung tierschutzrechtlicher Vorschriften außerdem Kleintierversuche mit Mäusen angestellt. Methoden wie Mehrfarben Durchflusszytometrie, (Multispot)ELISA, Westernblot, real time qPCR, Histologie und MR-/PET-CT-Bildgebung erlauben eine detaillierte Untersuchung und Charakterisierung. Technische Entwicklungen finden meist in Kooperation mit führenden Medizintechnikunternehmen aus dem Bereich der klinischen Hyperthermie statt, wobei (prä)klinische Fragestellungen stets mit berücksichtig werden.
Ausgewählte Publikationen
Rationale der Hyperthermie (rationale of hyperthermia)
Hader, M.; Frey, B.; Fietkau, R.; et al. Immune biological rationales for the design of combined radio- and immunotherapies. Cancer Immunol Immunother; 2020, 69, 293–306 doi.org/10.1007/s00262-019-02460-3
Präklinische Hyperthermie (preclinical hyperthermia)
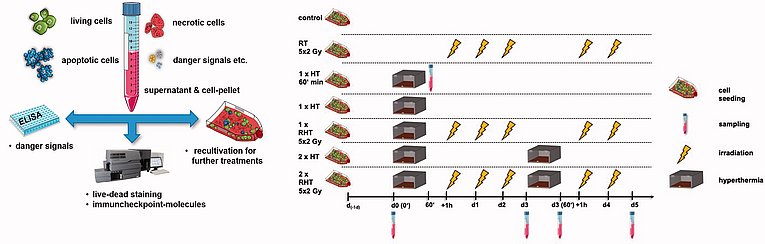
Hader, M.; Savcigil, D.P.; Rosin, A.; Ponfick, P.; Gekle, S.; Wadepohl, M.; Bekeschus, S.; Fietkau, R.; Frey, B.; Schlücker, E.; Gaipl, U.S. Differences of the Immune Phenotype of Breast Cancer Cells after Ex Vivo Hyperthermia by Warm-Water or Microwave Radiation in a Closed-Loop System Alone or in Combination with Radiotherapy; Cancers; 2020, 12, 1082. https://doi.org/10.3390/cancers12051082
Rosin, A.; Hader, M.; Drescher, C.; Suntinger, M.; Gerdes, T.; Willert-Porada, M.; Gaipl, U. S.; Frey, B. Comparative study and simulation of tumor cell inactivation by microwave and conventional heating.
COMPEL : The International Journal for Computation and Mathematics in Electrical and Electronic Engineering; 2018, 37 (6) . 1893-1904. doi.org/10.1108/COMPEL-03-2017-0144
Werthmöller, N.; Frey, B.; Rückert, M.; Lotter, M.; Fietkau, R.; Gaipl, U.S. Combination of ionising radiation with hyperthermia increases the immunogenic potential of B16-F10 melanoma cells in vitro and in vivo. Int J Hyperthermia. 2016; 32(1):23-30.
Schildkopf, P.; Frey, B.; Ott, O.J.; Rubner, Y.; Multhoff, G.; Sauer, R; Fietkau, R.; Gaipl U.S. Radiation combined with hyperthermia induces HSP70-dependent maturation of dendritic cells and release of pro-inflammatory cytokines by dendritic cells and macrophages. Radiother Oncol. 2011 Oct;101(1):109-15. doi.org/10.1016/j.radonc.2011.05.056
Klinische Hyperthermie (clinical hyperthermia)
Datta, N.R.; Kok, H.P.; Crezee, H.; Gaipl, U.S.; and Bodis, S.: Integrating Loco-Regional Hyperthermia Into the Current Oncology Practice: SWOT and TOWS Analyses. Front. Oncol. 2020, 10:819. doi.org/10.3389/fonc.2020.00819
Projekt-relevante eingeworbene Drittmittel
Bayerische Forschungsstiftung:
Multiskalenuntersuchung der Hyperthermie für neue additive Tumorbehandlungsstrategien (Microthermia)
European Union Horizon 2020 (HYPERBOOST):
ESR4- UKER: Elucidate the effects and reveal mechanisms of hyperthermia in combination with radiotherapy on the innate and adaptive immune system in pre-clinical model systems
ESR11-UKER: Monitoring immune effects of hyperthermia in multimodal settings with radiotherapy in patients and definition of prognostic and predictive markers
Kooperationspartner
Dipl.-Ing. Martin Wadepohl (Dr. Sennewald Medizintechnik)