Systemische Anti-Tumor-Immunreaktionen
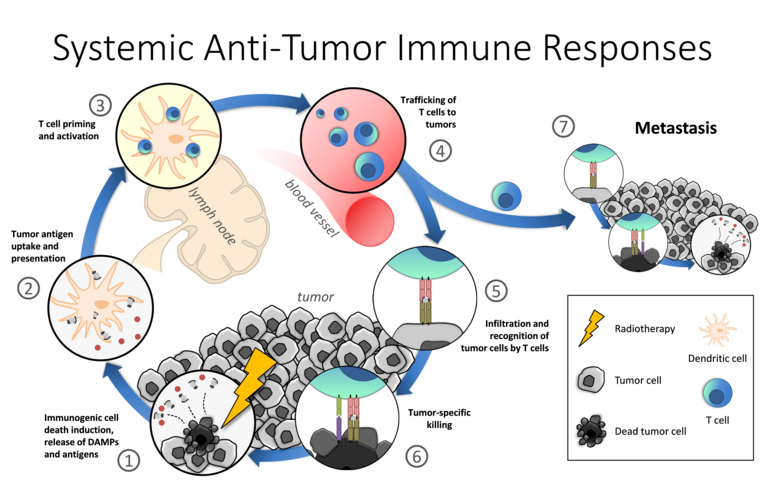
Das primäre Ziel der Strahlentherapie ist eine lokale Kontrolle des Tumors, indem Tumorzellen durch die ionisierende Strahlung abgetötet werden. Moderne Bestrahlungstechnik und -planung ermöglicht es im Rahmen von Hypofraktionierungsprotokollen eine höhere Strahlendosis pro Fraktion im Tumor zu deponieren, ohne dabei das umliegende Normalgewebe stärker zu belasten. Dies führt dazu, dass die Tumorzellen vermehrt einen immunogenen Zelltod sterben und die Mikroumgebung des Tumors so verändert wird, dass eine Anit-Tumor-Immunantwort begünstigt wird. Im Idealfall richtet sich diese Immunantwort dann nicht nur gegen den lokal bestrahlten Tumor, sondern hat auch systemische Auswirkungen auf eventuell vorhandene Metastasen. Der daraus resultierende Rückgang von Tumormasse außerhalb des Bestrahlungsfeldes, auch „abskopaler Effekt“ genannt, wird bislang allerdings nur selten in der Klinik beobachtet.
Eine zusätzliche Modulation Immunsystems durch Immuntherapien, wie z. B. Tumorimpfstoffe, kann die durch Strahlentherapie ausgelösten Anti-Tumor-Immunantworten verstärken oder, im Falle von Immun-Checkpoint-Inhibitoren, der immunsuppressiven Mikroumgebung des Tumors entgegenwirken. Die Kombination aus Strahlen- und Immuntherapien hat das Potential die Krebstherapie in Zukunft grundlegend verbessern und vermehrt systemische (abskopale) Effekte in den Patienten auszulösen. Bisher ist allerdings noch wenig bekannt, wie sich unterschiedliche Parameter der Strahlentherapie (Dosis, Dosisrate, Fraktionierung, Zielvolumen, etc.) auf das Immunsystem in verschiedenen Tumorentitäten auswirken, welche Immuntherapien sich in der jeweiligen Situation am besten eignen und wie sich die einzelnen Therapien gegenseitig beeinflussen.
In dieser Arbeitsgruppe werden die immunologischen Grundlagen der systemischen (abskopalen) Effekte in präklinischen Versuchen mit Melanom- und Brustkrebsmodellen untersucht. Dazu wird unter anderem ime Bestrahlung mit einem unter Hochdruck erzeugten Tumorzell-Impfstoff und Immun-Checkpoint-Inhibitoren kombiniert. Die mechanistischen Analysen beinhalten den Vergleich der Immunzellinfiltration und das Tumormikromilieu in bestrahlten und nicht-bestrahlten Tumoren. Dabei liegt ein besonderer Fokus auf der Tumorantigenpräsentation durch dendritische Zellen. Außerdem wird der Einfluss von bisher weniger erforschten Immun-Checkpoint-Molekülen auf die Immunsuppression durch den Tumor untersucht.
Das Ziel dieser Arbeitsgruppe ist deshalb die Erforschung der immunmodulierenden Wirkung verschiedener Kombinationen aus Bestrahlung und Immuntherapien anhand unterschiedlicher präklinischer Modelle, um die immunologischen Grundlagen systemischer (abskopaler) Anti-Tumor-Immunreaktionen besser zu verstehen. Mit diesem Wissen sollen dann zukünftig effektivere klinische Studien zu Strahlenimmuntherapien konzipiert werden können.
Aktuelle Projekt beinhalten:
- Die Kombination hypofraktionierter Bestrahlung mit einem unter Hochdruck erzeugten Tumorzell-Impfstoff und Immun-Checkpoint-Inhibitoren. Dabei liegt ein besonderer Fokus auf der Tumorantigenpräsentation durch dendritische Zellen. (IZKF Erstantragstellerprogramms (J102: „cDC1s bei abskopalen Effekten und HHP-Impfstoffen“) )
- Der Einfluss von bisher weniger erforschten Immun-Checkpoint-Molekülen auf die Immunsuppression durch den Tumor. (DFG Graduiertenkolleg GK 2599)
- Die Modulation des Komplementsystems durch ionisierende Strahlung. (BMBF Verbundprojekt ENDORSE [02NUK091B])
- Die Immuneffekte von Cannabidiol (CBD) in Kombination mit Strahlentherapie
(Zahn-)Medizin Doktorand/-Innen
Magnus Trottnow
Florian Schultz (GRK2599)

Methoden
Mehrfarben-Durchflusszytometrie
Präklinische Modellsysteme
CRISPR/Cas
Hochdruckinaktivierung von Tumorzellen
RNA-Sequenzierung
(Endpunkt-)PCR
Quantitative PCR
ELISA
Primäre Zellkulturen
MSD-System (Multi-Array-Technologie)
Ausgewählte Publikationen
Gehre, S., Meyer, F., Sengedorj, A., Grottker, F., Reichardt, C. M., Alomo, J., Borgmann, K., Frey, B., Fietkau, R., Rückert, M., & Gaipl, U. S. (2023). Clonogenicity-based radioresistance determines the expression of immune suppressive immune checkpoint molecules after hypofractionated irradiation of MDA-MB-231 triple-negative breast cancer cells. Frontiers in oncology, 13, 981239. https://doi.org/10.3389/fonc.2023.981239
Wedekind H, Walz K, Buchbender M, Rieckmann T, Strasser E, Grottker F, Fietkau R, Frey B, Gaipl US, Rückert M. Head and neck tumor cells treated with hypofractionated irradiation die via apoptosis and are better taken up by M1-like macrophages. Strahlenther Onkol. 2022 Feb;198(2):171-182. doi.org/10.1007/s00066-021-01856-4.
Rückert M, Flohr AS, Hecht M, Gaipl US. Radiotherapy and the immune system: More than just immune suppression. Stem Cells. 2021 Sep;39(9):1155-1165. doi.org/10.1002/stem.3391
Rückert M, Deloch L, Frey B, Schlücker E, Fietkau R, Gaipl US. Combinations of Radiotherapy with Vaccination and Immune Checkpoint Inhibition Differently Affect Primary and Abscopal Tumor Growth and the Tumor Microenvironment. Cancers (Basel). 2021 Feb 9;13(4):714.
doi.org/10.3390/cancers13040714
Seitz C, Rückert M, Deloch L, Weiss EM, Utz S, Izydor M, Ebel N, Schlücker E, Fietkau R, Gaipl US, Frey B. Tumor Cell-Based Vaccine Generated With High Hydrostatic Pressure Synergizes With Radiotherapy by Generating a Favorable Anti-tumor Immune Microenvironment.Front Oncol. 2019 Aug 28;9:805.
doi.org/10.3389/fonc.2019.00805
Weitere Publikationen von Dr. Michael Rückert finden Sie in der "Web of Science Researcher ID".
Projekt-relevante eingeworbene Drittmittel
BMBF Verbundprojekt ENDORSE [02NUK091B]:
Einfluss von (dicht-)ionisierender Strahlung auf die immunmodulatorische Wirkung des Komplementsystems: Neue Perspektiven für Gesundheitsschutz und Tumortherapie
Stellvertretender Verbundkoordinator und Projektleiter
DFG Graduiertenkolleg GK 2599 (Fine-Tuners of the Adaptive Immune Response):
Projekt: Role of TNFRSF14 in radiation-induced T cell-mediated anti-tumor responses
IZKF Junior-Projektleiter: J102 „cDC1s bei abskopalen Effekten und HHP-Impfstoffen“
Kooperationspartner
Prof. Dr. med. Dr. h.c. Friedrich Paulsen
Institut für Funktionelle und Klinische Anatomie, Friedrich-Alexander-Universität Erlangen-Nürnberg
Prof. Dr.-Ing. Schlücker
Lehrstuhl für Prozessmaschinen und Anlagentechnik, Friedrich-Alexander-Universität Erlangen-Nürnberg
Prof. Dr.-Ing. Michael Wensing
Department Chemie- und Bioingenieurwesen (CBI), Friedrich-Alexander-Universität Erlangen-Nürnberg
Prof. Dr. Claudia Fournier und Dr. Alexander Helm
GSI Helmholtzzentrum für Schwerionenforschung GmbH, Darmstadt
Fulvia Vascotto
TRON - Translationale Onkologie an der Universitätsmedizin der Johannes Gutenberg Universität Mainz gemeinnützige GmbH
Prof. Dr. Alberto Mantovani, Prof. Dr. Cecilia Garlanda, Dr. Elena Magrini
Humanitas Universität, Mailand, Italien
PD Dr. Franziska Eckert
Universitätsklinik für Radioonkologie, Medizinische Universität Wien, Österreich