Immunbiologie von Hirntumoren
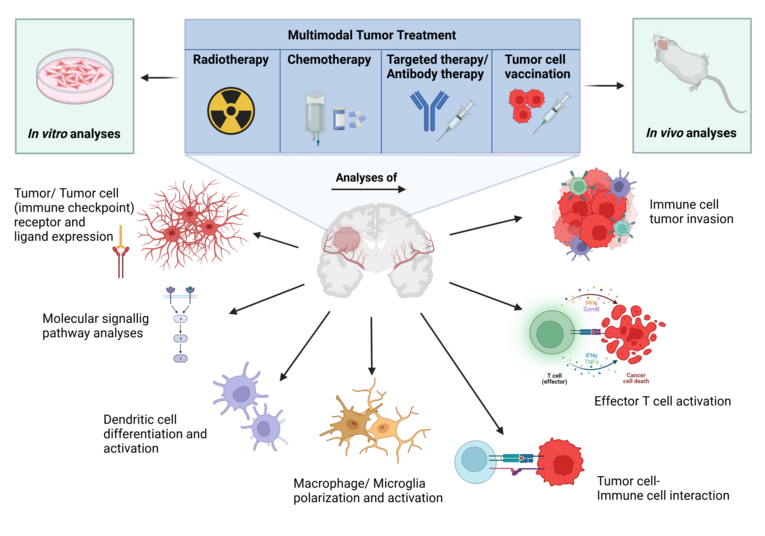
Beim Glioblastoma multiforme (GBM) handelt es sich um ein hoch-malignes, primäres Astrozytom, welches bedingt durch seine Lokalisation im Gehirn, ein infiltratives und schnelles Wachstum und die Unterdrückung einer erfolgreichen Anti-Tumorimmunreaktion eine sehr schlechte Prognose aufweist. Die derzeitige Behandlung beinhaltet, sofern möglich, eine operative Resektion, sowie Radio- und Chemotherapie. Immunologische Studienansätze zur Therapie dieses bösartigen Tumors bringen bisher nicht den erhofften Erfolg, weshalb Optimierungen der Behandlung dringend notwendig sind. Daher ist unser Ziel die Untersuchung der Biologie möglicher zellulärer und molekularer Wechselwirkungen, um langfristig eine Verbesserung der therapeutischen Intervention von bösartigen Hirntumoren zu erreichen. Die Arbeitsgruppe, welche durch die DFG gefördert ist, hat sich dabei darauf spezialisiert, immuntherapeutische Ansätze bei Gliomen inklusive Ganz-Zell-Tumorvakzine in präklinischen Modellsystemen in Kombination mit Strahlentherapie zu analysieren.
Die Forschung erfolgt dabei in vitro auf molekularer und zellulärer Ebene (Analyse von molekularen Signalwegen, Expressionsprofilen und der Wechselwirkung von Tumor- und Immunzellen) sowie physiologisch relevant in vivo im GBM-Modell. Dabei kommen zahlreiche Labortechniken zum Einsatz wie eine detaillierte phänotypische Bestimmung von Tumor- und Immunzellen mittels Mehrfarben-Durchflusszytometrie, Bestimmung von mRNA-Expression durch Real Time PCR und hochauflösender droplet digital PCR (ddPCR), Detektion von Proteinen durch ELISA und Western Blot, und Analyse von Zellen durch Fluoreszenz- und Durchlichtmikroskopie. Spezielle präklinische, syngene und orthotope Tiermodelle ermöglichen Analysen, deren Ergebnisse schneller in klinische Studien umgesetzt werden können.
Dr. rer. nat. Anja Derer
Gruppenleiterin
Telefon: 09131 85-44278 09131 85-32311
E-Mail: anja.derer(at)uk-erlangen.de
(Zahn-)Medizin Doktorand/-Innen
Mona Shojaei
Celina Schuster
Theodhora Shuti
Ausgewählte Publikationen
I Original Artikel
Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Schatz J, Ladinig A, Fietkau R, Putz F, Gaipl US, Frey B, Derer A. Strahlenther Onkol. 2022 Dec 8. doi: 10.1007/s00066-022-02028-8.
Chemoradiation Increases PD-L1 Expression in Certain Melanoma and Glioblastoma Cells. Derer A*, Spiljar M*, Bäumler M, Hecht M, Fietkau R, Frey B, Gaipl US. Front Immunol. 2016 Dec 22;7:610. doi: 10.3389/fimmu.2016.00610. *authors contributed equally
Rsk2 controls synovial fibroblast hyperplasia and the course of arthritis. Derer A*, Böhm C*, Grötsch B, Grün JR, Grützkau A, Stock M, Böhm S, Sehnert B, Gaipl U, Schett G, Hueber AJ, David JP. Ann Rheum Dis. 2014 Nov 20. PMID:25414238 *authors contributed equally
Blockade of IL-36 receptor signaling does not prevent from TNF-induced arthritis. Derer A, Groetsch B, Harre U, Böhm C, Towne J, Schett G, Frey S, Hueber AJ. PLoS One. 2014 Aug 11;9(8):e101954. PMID: 25111378
RSK2 protects mice against TNF-induced bone loss. Böhm C*, Derer A*, Axmann R, Hillienhoff U, Zaiss MM, Luther J, Zech C, Stock M, Scholtysek C, Engelke K, Hess A, Tuckermann JP, Schett G, David JP. J Cell Sci. 2012 May 1;125(Pt 9):2160-71. PMID: 22344264 *authors contributed equally
II Reviews
Modern Radiotherapy Concepts and the Impact of Radiation on Immune Activation. Deloch L*, Derer A*, Hartmann J, Frey B, Fietkau R, Gaipl US. Front Oncol. 2016 Jun 20;6:141. doi: 10.3389/fonc.2016.00141. Review. *authors contributed equally
Immune-modulating properties of ionizing radiation: rationale for the treatment of cancer by combination radiotherapy and immune checkpoint inhibitors. Derer A, Frey B, Fietkau R, Gaipl US. Cancer Immunol Immunother.2016 Jul;65(7):779-86. doi: 10.1007/s00262-015-1771-8. Review
Radio-immunotherapy-induced immunogenic cancer cells as basis for induction of systemic anti-tumor immune responses - pre-clinical evidence and ongoing clinical applications. Derer A*, Deloch L*, Rubner Y*, Fietkau R, Frey B, Gaipl US. Front Immunol. 2015 Oct 8;6:505. doi: 10.3389/fimmu.2015.00505. eCollection 2015. *authors contributed equally
Weitere Publikationen von Dr. Anja Derer finden Sie unter der "Web of Science Researcher ID".
Projekt-relevante eingeworbene Drittmittel
DFG:
Impact and mechanisms of PD-L1, PD-L2 and EGF-R expression on glioma cells following radiochemotherapy and its consequences for combination with vaccination and PD-1 inhibition
Kooperationspartner
Prof. Dr. Christoph Bert
Medizinische Strahlenphysik, Strahlenklinik Erlangen, Universitätsklinikum Erlangen
Prof. Dr.-Ing. Schlücker
Lehrstuhl für Prozessmaschinen und Anlagentechnik, Friedrich Alexander Universität Erlangen-Nürnberg.
Dr. Bettina Grötsch
Medizinische Klinik 3 – Rheumatologie und Immunologie, Universitätsklinikum Erlangen

